Hydration: Idratazione dei cementi
Se il calcestruzzo è un materiale da costruzione, lo deve al processo di idratazione (hydration) del cemento. Cioè a quel complesso sistema di reazioni chimiche tra il cemento e l’acqua, grazie al quale il calcestruzzo si trasforma da una massa inizialmente plastica, e quindi facilmente modellabile, in un materiale rigido e meccanicamente resistente come la pietra. Con il progredire della reazione chimica tra l’acqua e il cemento si manifestano due variazioni di tipo fisico-meccanico:- la prima consiste in una graduale perdita della lavorabilità iniziale del calcestruzzo fresco fino al tempo in cui l’impasto non è più modellabile (presa);- la seconda riguarda il successivo e progressivo aumento nella resistenza meccanica (indurimento).In realtà tra i due processi – presa e indurimento – non esiste soluzione di continuità, nel senso che la consistenza del materiale aumenta progressivamente passando da quella tipica di un fango, a quella di un terreno asciutto, ed infine a quella di una roccia sempre più compatta. 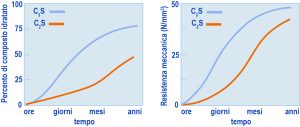 Fig. 1 – Andamento schematico degrado di idratazione dei silicati in funzione del tempo.Fig. 2 – Andamento schematico della resistenza meccanica a compressione dei silicati in funzione del tempo.La distinzione tra presa e indurimento attiene più agli aspetti pratici del processo produttivo che non a reali differenze nella cinetica del processo di idratazione: con l’inizio della presa termina (dopo una o più ore) il tempo a disposizione per poter mettere in opera e compattare il calcestruzzo; con l’inizio dell’indurimento (dopo 1 o più giorni a temperatura ambiente) diventa possibile disarmare le casseforme o rendere pedonabile la superficie di una pavimentazione, ancorché le prestazioni della struttura in servizio siano calcolate sulla base della resistenza meccanica a 28 giorni.
Fig. 1 – Andamento schematico degrado di idratazione dei silicati in funzione del tempo.Fig. 2 – Andamento schematico della resistenza meccanica a compressione dei silicati in funzione del tempo.La distinzione tra presa e indurimento attiene più agli aspetti pratici del processo produttivo che non a reali differenze nella cinetica del processo di idratazione: con l’inizio della presa termina (dopo una o più ore) il tempo a disposizione per poter mettere in opera e compattare il calcestruzzo; con l’inizio dell’indurimento (dopo 1 o più giorni a temperatura ambiente) diventa possibile disarmare le casseforme o rendere pedonabile la superficie di una pavimentazione, ancorché le prestazioni della struttura in servizio siano calcolate sulla base della resistenza meccanica a 28 giorni.
IL CEMENTO PORTLAND
Il cemento Portland, – la “madre” di tutti i cementi – è sostanzialmente costituito da clinker e gesso. Anche gli altri cementi sono sostanzialmente basati su questo binomio ancorché possa essere presente uno o più ingredienti accessori (pozzolana, cenere di carbone, loppa d’altoforno, ecc.).Nel clinker (il prodotto della cottura di una miscela di terre calcareo-argillose) sono presenti due silicati di calcio (circa l’80%) e due alluminati di calcio (circa il 20%). In linea di massima, i due alluminati (individuati dalle formule C3A vedi Nota 1 in fondo all’articolo e C4AF) contribuiscono, per reazione con l’acqua, al fenomeno della presa, mentre i due silicati (C3S e C2S) sono determinanti per l’indurimento. Per semplicità di esposizione si esaminerà prima il comportamento dei silicati e dopo quello degli alluminati.
IDRATAZIONE DEI SILICATI
Se il cemento fosse costituito da solo C3S o C2S si registrerebbe un perfetto parallelismo tra il decorso nel tempo della reazione chimica di idratazione (Fig. 1) e quello dello sviluppo della resistenza meccanica (Fig. 2). Si può notare che il C3S, rispetto al C2S, è più rapido sia nel reagire con l’acqua (Fig. 1) sia nello sviluppare la corrispondente resistenza meccanica (Fig. 2). Tuttavia, per entrambi i silicati si registrano una reazione di idratazione ed una resistenza meccanica trascurabili durante le prime ore, così come si registra una pressoché identica resistenza meccanica elevata alle lunghissime stagionature (anni). Naturalmente, il diverso comportamento (chimico e prestazionale) del C3S e del C2S a 1 giorno, a 1 settimana ed a 1 mese dal getto comporta una sostanziale differenza dal punto di vista pratico, ove si pensi all’importanza della resistenza meccanica a pochi giorni dal getto (per rimuovere le casseforme) o a 28 giorni per la determinazione della resistenza meccanica caratteristica sulla quale si basano convenzionalmente i dati progettuali. Da ciò deriva che, in generale, in un cemento Portland la quantità di C3S è molto maggiore rispetto a quella del C2S (circa 3:1), salvo i casi eccezionali in cui le prestazioni a 1 e 28 giorni non sono così importanti (per es. nelle dighe dove si caratterizza il calcestruzzo a 90 o 180 giorni) e nel contempo esistono altre esigenze (ridotto sviluppo di calore) per preferire un cemento con maggior contenuto in C2S che non in C3S.Nella Fig. 1 è riportata la percentuale di C3S o C2S che ha reagito con l’acqua in funzione del tempo. Ma quale è il risultato di queste reazioni di idratazione? In entrambi i casi si formano due tipologie di prodotto: un silicato di calcio idrato (indicato con la sigla C-S-H vedi Nota 2 in fondo all’articolo) e l’idrossido di calcio, Ca(OH)2 indicato anche con la formula CH secondo lo schema di reazione [1]:C2S v1+ H2O =======> C-S-H + CH [1]C3S v2 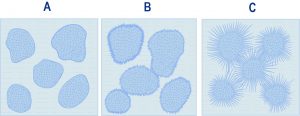 Fig. 3 – Idratazione schematica del C3S o C2S: subito dopo il mescolamento con acqua (A),inizio della presa (B) e durante l’indurimento (C).In realtà il processo di idratazione [1] avviene con una velocità (v1) minore se si tratta del C2S, e maggiore (v2>v1) se si tratta del C3S. Inoltre, la quantità di calce prodotta per idratazione (CH) è maggiore se riferita all’idratazione del C3S (30-40%) che non a quella del C2S, meno ricco di calcio (10-15%). Tuttavia, la reazione chimica [1], da sola, non è in grado di spiegare perché una pasta di C3S o di C2S (e quindi di cemento Portland) si trasforma gradualmente dalla iniziale massa plastica ad un materiale rigido e duro come una pietra. In realtà, tra i due prodotti della reazione, solo il C-S-H è determinante per l’indurimento, mentre la calce contribuisce in modo trascurabile a questo processo. Il C-S-H, ancorché si presenti in forme particellari diverse, è di natura prevalentemente fibrosa. Con il progredire della reazione [1], le fibre di C-S-H formatesi sui granuli di C3S o C2S adiacenti, prima si toccano e poi si intrecciano tra loro. Nella Fig. 3 sono schematicamente illustrati tre stadi del processo di idratazione: subito dopo il mescolamento quando la reazione non è ancora sostanzialmente partita ed il sistema è relativamente fluido (A); l’inizio della presa quando le fibre cominciano a toccarsi tra loro ed il sistema perde la sua plasticità iniziale (B); l’indurimento in atto quando le fibre, allungatesi per la progressiva idratazione dei silicati, si intrecciano tra loro e provocano l’irrigidimento del sistema.Le microfotografie della Fig. 4 mostrano la situazione reale di una pasta di C3S, al momento della presa e a indurimento avvenuto, così come è rilevabile con l’ausilio del microscopio elettronico a scansione. Si può notare, nella foto della Fig. 4, come tra le fibre esistano micro-cavità diffuse (denominate “pori capillari”) che influiscono negativamente tanto sulla resistenza meccanica quanto sulla durabilità del materiale: maggiore porosità significa maggiore permeabilità, e quindi maggiore penetrabilità del sistema cementizio da parte degli agenti aggressivi. Per ridurre la porosità capillare, e quindi aumentare sia la resistenza meccanica sia la durabilità, si può: ridurre – a parità di cemento (c) – il quantitativo di acqua (a) oppure – a parità di acqua – aumentare il cemento. In entrambi i casi si riduce il rapporto a/c e quindi si predispone un intreccio più densificato delle fibre (Fig. 5).
Fig. 3 – Idratazione schematica del C3S o C2S: subito dopo il mescolamento con acqua (A),inizio della presa (B) e durante l’indurimento (C).In realtà il processo di idratazione [1] avviene con una velocità (v1) minore se si tratta del C2S, e maggiore (v2>v1) se si tratta del C3S. Inoltre, la quantità di calce prodotta per idratazione (CH) è maggiore se riferita all’idratazione del C3S (30-40%) che non a quella del C2S, meno ricco di calcio (10-15%). Tuttavia, la reazione chimica [1], da sola, non è in grado di spiegare perché una pasta di C3S o di C2S (e quindi di cemento Portland) si trasforma gradualmente dalla iniziale massa plastica ad un materiale rigido e duro come una pietra. In realtà, tra i due prodotti della reazione, solo il C-S-H è determinante per l’indurimento, mentre la calce contribuisce in modo trascurabile a questo processo. Il C-S-H, ancorché si presenti in forme particellari diverse, è di natura prevalentemente fibrosa. Con il progredire della reazione [1], le fibre di C-S-H formatesi sui granuli di C3S o C2S adiacenti, prima si toccano e poi si intrecciano tra loro. Nella Fig. 3 sono schematicamente illustrati tre stadi del processo di idratazione: subito dopo il mescolamento quando la reazione non è ancora sostanzialmente partita ed il sistema è relativamente fluido (A); l’inizio della presa quando le fibre cominciano a toccarsi tra loro ed il sistema perde la sua plasticità iniziale (B); l’indurimento in atto quando le fibre, allungatesi per la progressiva idratazione dei silicati, si intrecciano tra loro e provocano l’irrigidimento del sistema.Le microfotografie della Fig. 4 mostrano la situazione reale di una pasta di C3S, al momento della presa e a indurimento avvenuto, così come è rilevabile con l’ausilio del microscopio elettronico a scansione. Si può notare, nella foto della Fig. 4, come tra le fibre esistano micro-cavità diffuse (denominate “pori capillari”) che influiscono negativamente tanto sulla resistenza meccanica quanto sulla durabilità del materiale: maggiore porosità significa maggiore permeabilità, e quindi maggiore penetrabilità del sistema cementizio da parte degli agenti aggressivi. Per ridurre la porosità capillare, e quindi aumentare sia la resistenza meccanica sia la durabilità, si può: ridurre – a parità di cemento (c) – il quantitativo di acqua (a) oppure – a parità di acqua – aumentare il cemento. In entrambi i casi si riduce il rapporto a/c e quindi si predispone un intreccio più densificato delle fibre (Fig. 5).
IL RUOLO DELLA CALCE
Sebbene la calce, prodotta per idratazione dei silicati secondo la reazione [1], non contribuisca di per sé allo sviluppo della resistenza meccanica per la sua morfologia non-fibrosa, tuttavia essa giuoca un ruolo altamente positivo da due altri punti di vista:
- a) produzione dei cementi pozzolanici e d’altoforno;
- b) protezione dei ferri di armatura dalla corrosione.
Il primo aspetto riguarda la possibilità di far contribuire anche la calce al processo di indurimento mediante l’aggiunta di pozzolana o loppa d’altoforno. Quest’ultima e ancor più la pozzolana sono caratterizzate dalla presenza di silice (amorfa) capace di reagire con la calce, prodotta per idratazione dei silicati, e di formare ulteriore C-S-H*:Il C-S-H* formatosi per la reazione pozzolanica (e qui contraddistinto con un asterisco) è cronologicamente “secondario”, rispetto al quello “primario” (C-S-H) che si produce direttamente nell’idratazione dei silicati. Esso si forma, cioè successivamente, a tempi più lunghi, perché la reazione pozzolanica [2] è più lenta del processo di idratazione [1], ma anche perché la sua formazione richiede che prima si accumuli un po’ di calce attraverso la reazione [1]. A seguito della duplice formazione di C-S-H (“primario”) e di C-S-H* (e “secondario”) in una pasta di cemento pozzolanico o d’altoforno stagionata a lungo, il sistema risulta più ricco in materiale fibroso e quindi meno poroso rispetto ad una pasta di cemento Portland a parità di rapporto a/c.Il secondo aspetto, che riguarda la protezione dei ferri di armatura, si basa sulla osservazione che in un ambiente basico, come quello che si produce nell’acqua satura di calce che riempie i pori capillari (pH = 13), il ferro risulta ricoperto da un film di ossido ferrico denso e compatto (passivazione) che lo protegge dalla corrosione (produzione di ruggine in presenza di umidità e ossigeno). Quando per effetto della carbonatazione (neutralizzazione della calce di idratazione da parte della CO2 penetrata dall’aria all’interno del calcestruzzo), il CH è completamente trasformato in CaCO3, il pH scende al di sotto di 9 e viene a mancare l’ambiente fortemente basico indispensabile alla condizione della passivazione dei ferri. Da questo punto di vista, i cementi pozzolanici e d’altoforno – che perdono progressivamente calce per effetto della reazione pozzolanica e produzione di C-S-H* secondario secondo la reazione [2] – sono potenzialmente più a rischio perché gli effetti della reazione pozzolanica si sommano a quelli della carbonatazione, favoriscono la scomparsa della calce e quindi la depassivazione dei ferri. In realtà – a parte i casi in cui si adotti un elevato rapporto a/c (> 0.60) – anche i cementi pozzolanici e d’altoforno si comportano molto bene nella protezione dei ferri dalla corrosione promossa dalla carbonatazione. Ciò dipende sostanzialmente da due situazioni entrambe favorevoli alla conservazione dello strato passivato dei ferri:
- a) la maggiore produzione di C-S-H (“primario” e “secondario”) nei cementi pozzolanici e d’altoforno favorisce la formazione di una matrice cementizia meno porosa e quindi meno penetrabile dalla CO2;
- b) per quanto la calce di idratazione reagisca con la pozzolana o la loppa secondo lo schema della reazione [2], ne rimane sempre una piccola quantità sufficiente a saturare egualmente la soluzione acquosa che riempie i pori capillari; infatti la solubilità della calce in acqua è di circa 1.5 g/l, e pertanto è sufficiente pochissimo CH per mantenere satura di calce l’acqua residua che riempie i pori capillari.
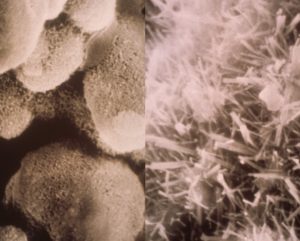 Fig. 4 – Pasta del C3S al momento della presa (a sinistra) e dell’indurimento (destra).
Fig. 4 – Pasta del C3S al momento della presa (a sinistra) e dell’indurimento (destra).
L’IDRATAZIONE DEGLI ALLUMINATI
Il C3A ed il C4AF (necessari per diminuire la temperatura di cottura del clinker e rendere ragionevolmente basso il costo di produzione del cemento) giuocano un ruolo determinante nelle prime ore di reazione tra acqua e cemento:C4AF v3+ H2O =======> C-A-H [3]C3A v4Fig. 5 -A parità di cemento, il sistema con meno acqua (cioè con il minor rapporto a/c) risulta meno poroso.dove C-A-H è la generica sigla che rappresenta una famiglia di prodotti di idratazione degli alluminati (Calcium-Aluminate-Hydrated): C3AH6, C2AH8, C4AH13, ecc. A differenza di quanto avviene per i silicati (Fig. 1-2), il C4AF e soprattutto il C3A reagiscono rapidamente con acqua (Fig. 6) senza tuttavia contribuire significativamente allo sviluppo della resistenza meccanica se si eccettua un rapido ma piccolo incremento durante le prime ore (Fig. 7).In sostanza alla rapida reazione degli alluminati con acqua (a velocità v3 per il C4AF e v4 per il C3A molto maggiore di quella v1 e v2 dei silicati) si accompagna una immediata perdita di plasticità (presa rapida), senza un rilevante incremento della resistenza meccanica (Fig. 7). Ciò dipende dalla morfologia dei cristalli di C-A-H, prevalentemente basata sulla presenza di lamine esagonali o cristalli cubici, e quindi poco favorevole, come avviene invece per i prodotti fibrosi C-S-H, allo sviluppo della resistenza meccanica.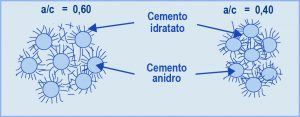 Fig. 6 – Andamento schematico del grado di idratazione degli alluminati in funzione del campo.Fig. 7 – Andamento schematico della resistenza meccanica a compressione degli alluminati in funzione del tempo.
Fig. 6 – Andamento schematico del grado di idratazione degli alluminati in funzione del campo.Fig. 7 – Andamento schematico della resistenza meccanica a compressione degli alluminati in funzione del tempo.
IL RUOLO DEL GESSO
Per ovviare all’inconveniente della presa rapida (< 60 min) – impossibilità a trasportare e gettare il calcestruzzo fresco entro tempi ragionevolmente lunghi – si ricorre all’aggiunta del gesso (CaSO4 · 2H2O) o dell’anidrite (CaSO4) che hanno la specifica funzione di rallentare la velocità di idratazione degli alluminati rispetto a quella del processo [3]:C4AF v3+ H2O+CaSO4·2H2O =======> C3A·3CaSO4·H32 [4]C3A v4Come si può vedere nel processo di idratazione [4], la presenza di gesso o anidrite, come regolatore della presa, modifica non solo la velocità di reazione degli alluminati (v’3<v3; v’4<v4) , ma anche il prodotto della reazione: ettringite (C3A·3CaSO4·H32) anziché C-A-H. In realtà le due modifiche sono tra loro correlate, ancorché la correlazione non appaia esplicitamente dal semplice confronto del processo [3], senza gesso, con il processo [4] con il gesso. L’ettringite che si forma durante le prime ore di idratazione degli alluminati nel cemento è detta “primaria”, per distinguerla da quella “secondaria” che si può formare successivamente in talune sfavorevoli. La formazione di ettringite “primaria” ritarda l’idratazione degli alluminati (eliminando l’inconveniente della presa rapida ed instaurando la presa normale) in quanto si deposita sulla superficie del C3A e del C4AF in forma di pellicola impermeabile (in realtà un feltro fittissimo di fibre) ed impedisce temporaneamente il contatto dell’acqua con il C3A e del C4AF. La quantità di gesso che occorre per regolare la presa del cemento è vincolata – in tutte le normative del mondo – da un limite superiore (3.5% – 4% come SO3 a seconda dei cementi, pari a circa 7-8% di gesso). Infatti, un eccesso di gesso – e quindi di ettringite secondo il processo [4] – potrebbe comportare indesiderati fenomeni fessurativi per l’azione espansiva che accompagna la formazione di ettringite dirompente.Di fatto, la quantità di gesso effettivamente impiegata (gesso optimum) viene individuata sulla base di due fattori: da una parte occorre che il gesso ritardi sufficientemente la presa del cemento; dall’altra la morfologia fibrosa dell’ettringite contribuisce, molto più del C-A-H, allo sviluppo soprattutto iniziale della resistenza meccanica; pertanto la resistenza meccanica del cemento Portland è maggiore di quella del corrispondente clinker, purché l’aggiunta di gesso rimanga al di sotto dei vincoli percentuali sopra menzionati per impedire l’espansione dirompente nel calcestruzzo.Nota 1. Nella chimica del cemento si adottano le seguenti formule abbreviate per individuare i composti chimici: C=CaO; A=Al2O3; F=Fe2O3; S= SiO2; H=H2O. Così la formula C3A sta per 3CaO·Al2O3 (o anche Ca3Al2O6), C3S corrisponde a 3CaO·SiO2 (o anche Ca3SiO5), C3AH6 indica 3CaO·Al2O3·6H2O, CH sta per Ca(OH)2.Nota 2. C-S-H non è in realtà una formula, ma piuttosto un acronimo inglese di Calcium Silicate Hydrated. Il C-S-H include una famiglia di prodotti (talvolta anche non ben individuabili per il loro carattere scarsamente cristallino) quali, per esempio, C3S2H3, C5S6H5, ecc.
